サイト・トップ |
ガスの科学ブログ |
ガスの科学目次 |
| 前の記事 | 45 |
次の記事 |
| 前へ | 目次順 |
次へ |
|
|
|
|
|||||||||||||
| (2)露点と水分量 | |||||||||||||
| ① 露点と沸点 | |||||||||||||
|
純ガスの成分表、不純物である水の量を摂氏温度(℃)で示しているが、これは、水の「露点温度(dew point temperature)」である。
水分は、超高純度ガスや半導体材料ガス中に含まれる不純物の中では、特に影響が大きいものである。ガスに含まれ、容器に付着する極微量の水分のコントロール、ガスを使用する設備中の水分の除去(ドライダウン)、極微量の水分量の分析など、ガス屋にとって、水分とは非常にやっかいで最も重要な物質(不純物)である。ガス中の微量水分の濃度の表示に「露点温度」あるいは「露点」という尺度が用いられている。 |
|||||||||||||
| 露点=液化開始点 | |||||||||||||
| 水分量を表わす「露点」を考える前に、本来の科学(熱力学)あるいは工学用語である「露点」と「沸点」について整理する。 | |||||||||||||
図に示すように、液化開始点の温度(露点)と沸騰開始点の温度(沸点)は等しい。しかし、通常は、「混合液体の沸点」と、それと全く組成が等しい「混合気体の露点」は異なる。したがって、液体と気体を接触させて各成分の分離(濃縮)を行う蒸留操作では、沸点とは別に露点という用語も必要になってくる。混合物では、沸点だけでなく露点の考えが必要になるということを模式的に示す。 |
|||||||||||||
|
|||||||||||||
| 「気体から液体への相変化点→露点」、「液体から気体への相変化点→沸点」であるが、純物質の場合、露点(液化開始点)と沸点(蒸発開始点)は等しいため、物性表には、沸点が示されることはあっても、露点が示されることはない。 | |||||||||||||
|
|||||||||||||
|
なお、物性の沸点は、「液体の表面で起こる気化」すなわち、蒸発現象が起こっている時の平衡温度であり、沸騰という言葉を用いている。しかし、工学(伝熱)の分野でよく知られる「沸騰現象」の「沸騰」はこれとは異なる定義がなされている。 工学における沸騰現象とは、「液体の表面からだけでなく内部からも激しく起こる現象」である。液体の内部からの気化現象・沸騰と液体表面からの蒸発とは異なる現象として取り扱っている。 たとえば、大気圧下(101.3kPa)で、水の沸点は、100℃であり、100℃の温度で激しく沸騰する。水面だけでなく水の中からも激しく蒸発するのが、普通の沸騰状態(核沸騰)である。しかし。沸点以下の温度でも、空気が乾燥していれば、水面から水が蒸発し水蒸気となって出ていくので蒸発は沸点以下でも起こる。この場合、水の表面を外圧として押しているのは、通常は空気であって、その気圧がその時の水の沸点を決めているが、沸点以下での蒸発が起こるので、「沸騰」と「蒸発」を使い分けているということになる。 上の図は、液体窒素と気体の窒素だけの単一成分の系での沸点を示しているが、露点に達した窒素をさらに冷却していくと、気相が全くない「全液」の状態になり、温度が露点(この場合は沸点でもある)よりさらに低下していくと「サブクール液体」という状態になる。サブクール状態の液体窒素には蒸気が全く存在しない。すなわち、沸点以下では、気体が存在しないというのが普通の状態である。 水と水蒸気の挙動を考える場合、水蒸気以外に空気の存在を前提とすることが多いため、沸騰や蒸発の取扱がやや特殊である。 もし空気を含まない水の単一の系があれば、100℃の時の飽和蒸気圧は101.3kPaであり、もしこの蒸気圧のまま、水の温度が100℃以下、すなわち沸点以下の温度になれば、水は全く蒸発することができず、要するに沸点以下の温度では蒸発は起こらない。サブクールの液体であれば、たとえ水であっても蒸発はできないので、液単相の状態になるはずである。 しかし、通常は空気が共存しており、空気は100℃以下の温度でもその温度に対応した水の蒸気圧までの水蒸気を含むことができる。水は、沸点に達していない温度でも相対湿度が100%になるまで気化することできるということになる。20℃や30℃でも空気中には水蒸気が存在するが、これは空気の存在があるからであって、純粋に水単独での物性ということではない。たとえば、水の場合でも配管中に101.3kPaの圧力で温度が100℃以下の水が流れていれば、(溶存する空気は全くないとして)水蒸気の気泡はできず、気相はできないということになる。 要するに沸点以下の温度では蒸発が起こらない、気相は存在しないとするのが普通である。沸点以下の蒸気圧というのは、他の気体の存在があってはじめて定義が可能になる。 |
|||||||||||||
| 混合液体の沸点、混合気体の露点 | |||||||||||||
| 中学校や高校の物理では、沸騰が始まり、全ての液体が蒸発するまで、温度は変化しないと習う。ヤカンの水が沸騰している間は、水と水蒸気の温度はずっと100℃であってそれ以上にはならないので、ヤカンが溶ける心配はない。沸騰中は温度は一定である。 一方、混合物を取り扱う場合には、沸点と露点は分けて考える必要がある。 混合液体は、その時の組成に応じた沸点で蒸発するが、その時の気液の界面における、液相の組成とそれに平衡な気相の組成は(特別な場合を除いて)異なる。これを「気液平衡」と呼び、蒸留とはこの性質を利用する分離技術である。もし、このまま、混合液体が補給されない状態で蒸発が続けば、残った液体の組成は変わっていき、沸点も変わっていく。蒸発の開始から蒸発の終了まで温度が一定ということはないということになる。 |
|||||||||||||
|
|||||||||||||
| 気相からみた露点と液相からみた沸点は、同じようにみえても、それぞれの組成は異なっているので、これを同じ組成のものを同じ物質だと考えると(この場合は、窒素:酸素=80:20の空気)、露点と沸点の値は異なるということになる。純物質では、沸点と露点は同じ値であるが、混合物の場合は、同じ組成の液体の沸点と気体の露点が異なるということは、非常に重要なことである。 | |||||||||||||
また、混合液体が蒸発する時、あるいは混合気体が液化する時、それぞれと平衡関係にある気体あるいは液体は、元の液体あるいは気体とは組成が異なるということも、非常に重要な物質の性質であり、多くの混合物がこの性質を持つため、気液平衡を利用した蒸留分離が可能となっている。 |
|||||||||||||
|
|||||||||||||
| ② 水分量を表わす「露点」 | |||||||||||||
| 混合物の場合は、沸点だけではなく露点も考慮しなければならないことを示した。一方、空気やガス中に含まれる水分の量を表わす尺度として「露点」という用語が、このような露点とは全く意味の異なる別の用語として用いられてきた。 前述の「純ガス」の仕様例の「露点」は、古くから慣習的に用いられてきた「水分量」である。 |
|||||||||||||
| 水分(水蒸気)を含むガスの温度が下がっていき、結露が始まる時、その温度とガス中の水分量には相関関係があり、その時の「露点(dew point)」あるいは「露点温度」によってガス中の水分量(濃度)を表わすことが行われている。この場合の露点は、表示は温度であるが、内容は水分量である。 空気中の水分量が多く、「相対湿度」が100%になると結露が生じるが、この時の温度が、空気中の水蒸気に対する露点であり、飽和蒸気圧線図から水蒸気圧あるいは水分濃度を得ることができる。空気だけでなく産業ガス製品でも同じであり、露点が高いガスは、そこに含まれる水分量が多く、露点が低いガスはそこに含まれる水分量が少なく、乾燥しているということになる。 |
|||||||||||||
| 産業ガスのガス製品は、基本的に非常に乾燥しており、そこに含まれる水分量は、極めて微量である。空気中の水分であれば、飽和蒸気圧に対する実際の水蒸気圧である相対湿度が用いられ、湿度50%といった表示で乾燥状態を表すことが行われている。 しかし、産業ガスの相対湿度は、ほぼゼロ、完全に乾いた状態であり、わずかに存在するガス中の水分量を表わすのに相対湿度を用いることはできない。しかしガス中の水分は、非常に微量であっても、ガスの利用方法によっては非常に大きな影響が出ることが多く(特に半導体産業などの電子機材向けのガスでは顕著k)、微量の水分量の値を示す方法が必要である。 |
|||||||||||||
| 現在は、ガス中の微量の水分を測定できる様々な装置(微量水分計)が開発されているが、昔は、乾燥しているガス中の微量の水分量を正確に測定することは容易ではなかった。 はじめに考案された測定法は、ガスの温度を徐々に下げて、どこで結露が起こるかということを観測し、その時の温度でガス中の水分量を求め、表示するというものである。ガスの温度を下げていき、飽和蒸気圧を下げ、相対湿度が100%になって結露が起こり、これを利用する「鏡面冷却式水分計」というガス中微量水分測定装置がある。水分計の中に導入された試料ガスの温度を徐々に下げると、含まれる水分の結露あるいは着霜が起こり、鏡面に曇りが発生し、その時の温度を正確に読み取る装置が組み込まれ、水分量を測るという仕組みである。 測定された温度から水分量(濃度)を計算によって求めることができるが、測定温度そのものを水分量とする方法が広がり、微量水分を「露点」という尺度で表わすようになった。そのため、水分計のことを「露点計」と呼ぶこともあった。 |
|||||||||||||
| 露点(温度)が高いガスは、高い温度で結露が起こるため、水分量が多いガスであり、露点(温度)が低いガスは水分量が少ないガスということになる。前述の仕様例の水分量、-70℃以下、-80℃以下、とあるのは、この温度よりも低い温度でなければ、水の凝結が起こらない、という程の水分量しか含まれていないということであり、これは、このくらい低温にしなければ結露・着霜が起こらないくらい乾燥したガスであるということを、直感的にも分かりやすくしているとも言える。 | |||||||||||||
| 結露・着霜状態を観測する冷却式の水分計(露点計)は、初期のものは、着霜が目測で行われたが、その後、観測方法も、機械式、フォト・ダイオード検出などに進化し、冷却方法の改良、温度の測定精度の向上などによって、より高感度のものが製作されるようになった。 現在では、結露・着霜の現象以外の測定方法を用いる水分量測定装置、たとえば静電容量式露点計などの水分計が増えており、他の不純物同様に、ガス中の微量水分量も、ppmやppbで表わすことが可能である。しかし、初期のこのような水分測定方法と、結露、着霜から直感的にイメージされることから、「露点=水分量」という尺度が現在でも使われている。 |
|||||||||||||
水(水蒸気)の結露は、混合ガス中の気体の液化現象であるから、正しくは、空気と水の混合ガスの気液平衡として考えなければならない。しかし、水の物性(特に分子間力)は、空気の成分である酸素、窒素、アルゴンなどの物性とは大きく異なっているため、冷却した時に、空気中の水蒸気だけが単独で液化し、空気の他の成分の液化は、無視できると考えることが可能である。 |
|||||||||||||
| 図に、窒素の液化と、空気中の水の液化の違いを表す。 図の左側は、窒素が液化し飽和液体と飽和蒸気が存在する状態を表わしている。温度は、平衡温度であり、純物質である窒素の蒸気からみた露点(液化)と液体窒素からみた沸点(気化)は同じであり、標準大気圧下では、約77Kである。 |
|||||||||||||
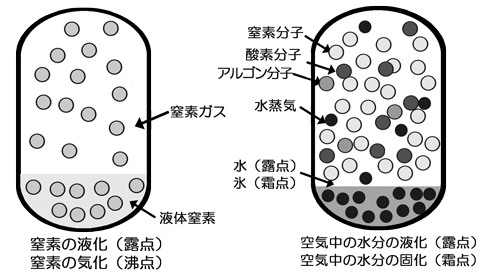 |
|||||||||||||
| 図の右の容器は、空気中の水分だけが液化している様子を示している。空気(酸素、窒素、アルゴンなどの混合ガス)の露点よりもはるかに高い温度(約200K〜300K)で空気中の水蒸気だけが選択的に、液化または固化している様子を表わしている。 実際は、空気の分子(酸素分子、窒素分子)と水分子、それぞれの間の分子間力が複雑に絡み合って凝集(液化)が起こるはずであるが、水分子どうしの分子間力だけが極端に大きく、その他の組み合わせ、たとえば、窒素分子と水分子、酸素分子と水分子、酸素分子どうし、窒素分子どうし、酸素分子と窒素分子などの分子間力をほとんど無視できるほど小さい。 液相あるいは固相中の水と気相中の水(水蒸気)が平衡関係にあり、この場合、空気は気相中にのみ存在し、水の液化や固化に対して「不活性なガス」とみなすことができる。厳密には水分子どうし以外に分子間の相互作用、分子間力が全く働かないということはないが、水分子の分子間力は非常に大きく、-100℃(約180K)程の温度では、酸素分子や窒素分子の液化は全く起こらないと考え、水だけが選択的に液化されると考えるのである。 |
|||||||||||||
| 分子の間に働く力が極端に異なり、水だけが選択的に液化するとみなせる場合、この場合の空気のように水分量の分析や測定に影響を及ぼさない不活性なベースガスのことを「マトリックスガス」と呼ぶ。非常に厳密な分析計や水分量の研究では、条件を揃えるために、空気ではなく窒素ガスが用いられることもあるが、基本的には、窒素も空気も、露点から求められる水分量の測定に影響を与えないマトリックスガスと考えることができる。 | |||||||||||||
|
|||||||||||||
|
|||||||||||||
| なお、試料ガスの圧力(全圧)が異なると水分の量(水蒸気の分圧)も変わるので、通常の水分計は、標準大気圧を全圧とするように校正されている。そこで、露点から濃度の関係を正しく求めるためには、測定部の試料ガスの圧力に注意を払う必要がある。(試料ガスの出口側を塞いで測定部の圧力を上げてしまうと露点が高く表示される) | |||||||||||||
なお、一般的なガスは、水分の液化・固化には影響を与えないため、ガス中の水分濃度と露点温度の関係はガス種にはよらないとされているが、結露以外の水分量測定法では、ガスの違いが、測定値へ影響することがあり、たとえばガス種による光の吸収の違いなどがあるため、校正ガスと異なる試料ガス中の水分の測定では、その影響を考慮する必要がある。 |
|||||||||||||
| 露点と霜点 | |||||||||||||
ここで、ガス中の水分量は微量であるため、露点は非常に低く、実際には水と水蒸気の平衡ではなく、氷と水蒸気の平衡となる。ガスの冷却時に起こる現象は、結露(凝縮)ではなく着霜(昇華)となることに注意しなければならない。 |
|||||||||||||
|
|||||||||||||
これに対して、通常の産業ガスの製品に含まれる水分は極めて微量であり、氷の蒸気圧に対応する霜点は、-50℃以下となる。このような低温の過冷却水が存在しないため、通常、露点と呼んでいるものは、実際は全て氷の蒸気圧に対応するもの「霜点」である。 |
|||||||||||||
| ガスのハンドブックや手帳には「露点−濃度換算表」という便利な表があるが、ここには、「0℃以下は氷の蒸気圧である」という注釈がついている。産業ガスに含まれる水分量は、厳密には全て霜点であるにも関わらず、呼び方は全て露点ということになっている。 超微量水分量として「-80℃以下の微量水分量」と表示されている場合、実際は露点が -80℃ 以下ということではなく、霜点が -80℃ 以下である、ということを意味している。 |
|||||||||||||
超高純度ガス中の微量の水分は、半導体製造プロセスなどに影響を与える。これを、できる限り少なくする技術が必要であるが、容器、配管、機器類に付着(吸着)している水分やガス中の微量水分を除去することは容易ではない。 |
|||||||||||||
| また、超微量の水分はそれを除去、管理することが難しいというだけではなく、その水分量を測定するための標準を決めることも容易ではない。 国の研究機関などでは、超微量水分のトレーサビリティに関する研究が行われている。厳密な測定では、条件をそろえるために、マトリックスガスには、空気ではなく超高純度の窒素が用いられ、水蒸気の発生には、超純水を用いた霜点発生装置、最新のCRDS微量水分計などが用いられている。 |
|||||||||||||
| 露点計とその他の水分計 | |||||||||||||
|
|||||||||||||
| CRDS(キャビティリングダウン方式レーザー分光法、Cavity Ringdown Spectroscopy): | |||||||||||||
| キャビティリングダウン分光法は2 枚の高反射ミラーで光学キャビティーを構成、閉じ込められた光は反射の度に強度を減衰させながら反射を繰り返し、一部の光はミラーを透過してくるので、その強度の減衰を観測することでキャビティー内の物質の密度と速度を測定する方法。 CRDS装置は、中赤外の量子カスケードレーザ(QCL、 GaAs/AlGaAs系あるいは GaInAs/AlInAs系の半導体レーザー、実用化は1994年と比較的新しい)と高反射率ミラーキャビティを用いる超高精度の吸収分光装置である。 信号の時間的な減衰、リングダウン信号を解析して微量成分の濃度を測定、高感度の微量水分測定に利用されるようになっている。 |
|||||||||||||