サイト・トップ |
ガスの科学ブログ |
ガスの科学目次 |
| 前の記事 | 86 |
次の記事 |
| 前へ | 目次順 |
次へ |
|
|
|
|
|||||||||||
| 小さな階層(メゾスコピックよりも小さな階層) | |||||||||||
| 人間の階層100mから髪の毛、細胞の階層10-6mまではマクロスコピックな階層である。 小生物や微生物の世界は、虫眼鏡や顕微鏡などの道具がないと観察できない小さな領域であるが、古典的な物理学が、ほとんど補正されることなく適用できる領域であり、マクロスコピック・巨視的階層である。 われわれの日常の常識は、マクロスコピック領域の常識であるが、階層が小さくなってくると、メゾスコピック(ナノスケール)あたりから次第に通用しなくなってくる。そこから、さらに小さな分子・原子の階層になると、ミクロスコピックな「量子」の世界となり、マクロスコピックの常識が(全く)通じない不思議な世界が現れる。 |
|||||||||||
| 分子や原子を理解し、物質や材料を取り扱うためには、20世紀の物理学が必要である。ミクロスコピックの階層を取り扱うための科学、量子論がなければ、ガスの分子を理解することもできない。たとえば、19世紀までの理想気体の概念では、気体は液化しない。19世紀末には、実在気体が液化されるようになり、分子の大きさや分子間力によって説明されるようになった。しかし、アルゴンやヘリウムのような希ガスの液化は、ファン・デル・ワールスが考えたような分子間力では、まだ説明することができない。量子力学から生まれた量子化学による説明が必要である。 | |||||||||||
| 原子よりもさらに4桁小さい階層が、原子核である。原子は非常に小さいが、その質量のほとんどは原子核が占め、その原子核は原子よりもはるかに小さい。原子の大半の質量を占める原子核は、原子のうちほんのわずかな部分を占めるだけであり、原子の中は、スカスカであるということが、20世紀になって初めて理解されるようになった。宇宙は、ほとんどが何もない空間であるが、物質の世界も、ほとんど何もない空間ばかりである。 | |||||||||||
| 科学は、分子、原子、原子核とどんどん小さなものにたどり着いたが、原子核はそれでも基本粒子(素粒子)ではなかった。20世紀初頭には、原子核の中にある陽子や中性子が発見され、素粒子だと思われたことがあったが、これらも素粒子ではなく、さらに小さな素粒子がその下の階層に存在することが分かった。 20世紀中盤の教科書や啓蒙書には、いたるところに、「陽子や中性子のような素粒子」という言葉が見られたが、素粒子はこんなには大きくはなかった。 素粒子の階層は、非常に小さく、素粒子は、それ以上の内部構造を持たない。したがって「粒子」とは呼んでいるが、粒子という言葉からイメージされる3次元的な球形の粒ということではない。 |
|||||||||||
| さらに人間が考えることができる最も小さな階層は、プランク単位系における長さの単位、プランク長(1.616x10-35m)とされている。プランク長は、通常の物理学が取り扱う最小の階層であり、観測可能な宇宙1027mからプランク長さまで、現代の科学が対象とする階層は、10進数で62桁の範囲(2進数で206桁)にある。このうち、およそ50桁の範囲は、まだ純粋科学の領域であるといわれているので、一般の科学技術、文明、社会、産業の階層は、およそ、102mから10-10mまでの、12桁ほどの範囲に収まる。 しかし、階層が一桁異なるだけでも、現象が大きく変化することも多く、この実質的な階層の範囲12桁というのは特に狭いということではない。マクロスコピックからメゾスコピック(ナノ)、ミクロスコピックまで広がる12桁である。 |
|||||||||||
| 電子は、非常に小さな階層 | |||||||||||
| 化学や工学にとって最も重要な粒子である「電子」は、この階層の中には収まらず、飛び抜けて小さい。ローレンツの古典的電子論では、電子を帯電した球とみなして取扱う。
CODATAでは物理定数の1つとして、2.818X10-15mと公表している。その他の実験からは電子の「大きさ」は、10-18mよりも小さいという結果も得られているが、一般的な取り扱いでは、電子は大きさを持たなくても不都合ではないということも多く、空間的な広がりのない「点電荷」として取り扱われることもある。また、電子は素粒子である。素粒子は、それ以上の内部構造を持たず、物質としてそれ以上分割できないので「素」粒子と呼ばれているが、これから、電子の内部と外部の境界を決める明確な定義を持たない、と考えることもできる。したがって電子には大きさがないという言い方もできる。 原子の大きさが10-10m、原子核の大きさが10-14mのあたりにあることを考えると、素粒子である電子は原子や原子核に比べて非常に「小さい」ということは間違いない、あるいは大きさがない。 化学の領域は、細胞から分子まで、およそ4桁~5桁の階層にあり、この階層の科学が最も重要である。しかし、化学反応に最も重要な役割を果たしている電子だけは、飛びぬけて小さい。 |
|||||||||||
| 分子よりも小さな階層の概略、分子から素粒子まで | |||||||||||
| イラストに、分子より下の階層を示す。原子、分子、化合物の階層は、およそ 10-10m(0.1nm)である。 | |||||||||||
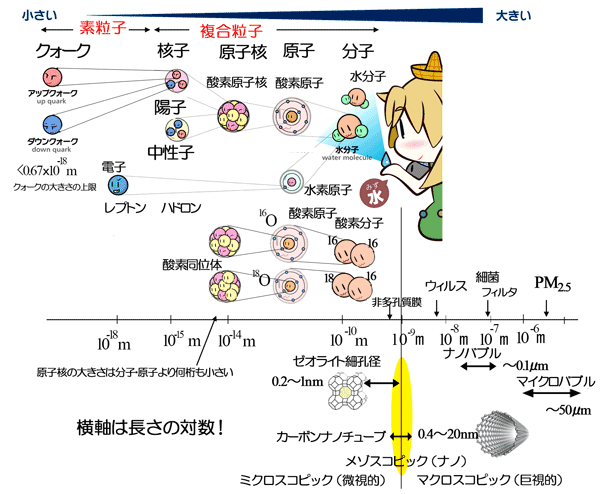 |
|||||||||||
| 図 分子より下の階層(原図は、HiggsTan(ひっぐすたん)のHPのものを利用) | |||||||||||
| 反応の過程において、原子核だけの粒子、たとえば、水素イオン(陽子)やヘリウム原子核(α線)あるいは、高温ガス中で反応するプラズマを考える場合では、さらに小さな階層である10-14m~10-15m(10fm~1fm、フェムトメートル)も考えられる。 | |||||||||||
| 全ての元素には、同じ元素の中に、異なる核種の原子(安定同位体と放射性同位体と核異性体)が多数あるため、元素の種類(118種類)に対して元素を構成する原子(atom)の種類(核種)はかなり多く、2000~3000種類ほどある。 産業ガスのビジネスでは、商材として、軽元素の安定同位体(ヘリウム、水素、炭素、酸素など)を取り扱う。分子は、10-10mの階層にあるが、同位体で構成される分子の違いは、原子核の中の核子(中性子数)の違いであるため、議論の対象(同じ元素の異なる同位体の違い)となる階層はかなり小さい(10-14m)。 |
|||||||||||
| イラストの階層を小さい方(左側)から眺めてみる。 素粒子である電子やクォークは非常に小さく、おそらく10-18mよりも小さい。素粒子は、物質の最小単位であり、ここまで小さいと空間的大きさという概念よりも、粒子の持つ質量(エネルギー)を議論することが多くなり、高エネルギーを利用した研究の領域である。 |
|||||||||||
| 素粒子が集まって「複合粒子」(composite particle)が作られる。 クォークと核力からなる「核子(陽子、中性子)」、核子と核力からなる「原子核」、クォークと反クォークからなる「中間子」、原子核と電子からなる「原子」などは、それ自体が単体の粒子のように振る舞うと考えることもできるので、複合粒子と呼ばれる。 複合粒子と素粒子は、階層が全く異なっていることがイラストから分かる。原子の組合せである分子の階層は原子の階層と同じであるが、種類は非常に多く、低分子、高分子、同位体を含む化合物、異性体、など、天然物と人工物の種類の数は非常に多い。 |
|||||||||||
| 図の右の方には、ウィルス、カーボンナノチューブ、分離膜、合成ゼオライトの大きさも示した。合成ゼオライトの細孔径は、オングストロームサイズで、分子サイズほど小さいが、生物やその他の人工物は、ミクロスコピックな世界から見ると、とてつもなく大きいことが分かる。メゾスコピックの領域を代表するカーボンナノチューブ(CNT)も、人工物としては、非常に微細な構造を持ち、その径は、0.4nmから20nmと非常に小さいが、それでもミクロスコピックからみると巨大である。 | |||||||||||
| ガス分子の階層、ナノメートルよりも一桁小さいガス分子 | |||||||||||
|
|||||||||||
| ヘリウムは、非常に漏れやすいという性質を利用して、溶接の欠陥や配管の接合部、継手などの小さな漏れの検出に利用されている(ヘリウム・リーク・ディテクターによる気密試験)。ヘリウムが漏れなければ、その他のガスは全く漏れないと考えてよい。ただし、漏れ易いとはいっても、肉厚のある高圧ガスの容器に閉じ込めておくことができないというほど漏れるということではないので、ヘリウムの取り扱いには通常の容器や配管類が使用できる。 | |||||||||||
| ガス分子と吸着材の相互作用 | |||||||||||
| 「合成ゼオライト」という材料が実用化されており、吸着材として使用した場合、吸着されるガス分子に対して選択性(ガス種による吸着量や吸着速度などの違い)があるため、この性質を「分子ふるい効果」と呼ぶことがある。 分子ふるいを意味する「モレキュラーシーブス」という商品名も比較的よく知られている。長さの単位オングストローム(Å、au)がゼオライトの細孔径(吸着材の結晶構造の中の微細な孔の大きさ)を表すのによく用いられたため、この数字とモレキュラーシーブスの名称を組み合わせて合成ゼオライトを呼称することがある。 たとえば、細孔径の分布が5 Å付近にピークのあるA型ゼオライトを「モレキュラーシーブス5A」などと呼んだ。この他にも細孔径や結晶構造によって3A、4A、13Xなどの名称が知られている。 |
|||||||||||
| なお、吸着材(adsorbent)は、ガス分子などを吸着する物質であるが、固形の錠剤のような形状をしたものが多く、同じ発音で「吸着剤」という表記もよく用いられる。医薬品や試剤には、液剤、錠剤、粉末、カプセルなど様々な剤形があり、その工程を製剤と呼ぶが、活性炭や合成ゼオライトのような吸着材料にも製剤と似たような整形のための造粒という工程がある(通常の吸着剤は液剤やカプセルではなく固体である)。 なお吸着という用語は、化学スペクトルの権威であるハインリヒ・カイザーが、20世紀初頭に作った新語「Adsorption」の日本語訳であり、「吸収(absorption)」とは、別の現象として定着している。 蒸留と吸着は、ガスの分離や精製プロセスに広く利用されている最もよく知られた分離の仕組み(単位操作)であるが、蒸留が錬金術の時代やもっと古い時代から実用化されている技術であるのに対して、吸着は、20世紀以降に実用化された非常に新しい技術である。吸収や吸着現象を利用した精製・分離は古くから知られているが(脱臭など)、吸着現象という概念として研究され、ガスの精製に用いられるようになったのは最近のことである。 |
|||||||||||
| 1Å=0.1nmであるから、現在の単位系にすると、合成ゼオライトの細孔径は0.5~1nm付近に多く分布しており、この大きさは、単原子分子や二原子分子の大きさに近い。 窒素分子と酸素分子は、分子の質量数では、それぞれ28対32とかなり大きな開きがあるが、図に示すように原子の大きさは、それほど大きくは変わらず、原子番号が大きい酸素(0.304nm)の方が、原子番号の小さい窒素(0.310nm)よりも少しだけ小さい。窒素も酸素も二原子分子であり、分子の大きさもそれほど大きくは異なっていない。 |
|||||||||||
| しかし、平均的な合成ゼオライトであれば、空気中の窒素ガスの方が空気中の酸素ガスよりも(同じ温度、分圧の時に)多く吸着されるので、この特性を利用してガスを分離することができる。分子の大きさは、それほど大きくは異なっていないが、ガス種によって吸着特性が異なり、選択性があるため、これを「分子ふるい(molecular sieve)」効果と呼んでいる。しかし、これは粉末や粒を大きさで篩分けるメッシュのような実際の機械的「篩(ふるい)」とは異なる。「ふるい」とはいっても、本物のふるいのように、大きさだけで分けているということではない。 | |||||||||||
| 合成ゼオライトは、その構造に固有の細孔を持っており、吸着特性は、様々な因子によって決まっている。たとえば、①細孔構造の次元、員環数、形状②細孔径の分布(全てが同じ細孔ではなく分布がある)と細孔の比表面積③シリコンと金属イオンの比の違いによる親水性・疎水性の違い④ガス分子と吸着材の極性⑤ガス分子の大きさと形状⑥温度⑦圧力⑧拡散係数⑨他のガス分子の影響、などが考えられ、細孔径を示す数字だけで分子ふるいが行われる訳でない。分離操作は、このような要因から決まる特性、ガス種による平衡吸着量の違いあるいは吸着速度の違いを利用して行われる。一般的には、吸着材が再生再使用されるため、吸着工程と脱着工程の両方の特性を考慮した分離装置が設計される。脱着とは吸着とは逆の反応で、吸着材に吸着したガス分子が放出される現象である。 | |||||||||||
| 吸着や脱着に伴う反応熱は、蒸発潜熱と同じくらい大きいため、吸着材を用いたガスの分離装置は、熱移動と物質移動の両方を考慮して設計されている。 | |||||||||||
| 同位体の間には大きさの違いがほとんどない | |||||||||||
|
|||||||||||