第32回 エネルギーの発明(3)エネルギーを表現する関数
|
2017/12/03 |
| |
修正 12/6、2018/3/5 |
|
|
|
| ①熱力学関数のルジャンドル変換 |
 |
ルジャンドル変換とは、「関数の変数を入れ替える」変換であり、元々は解析力学のために作られたものである。エネルギーとは活力のようなものであり、運動エネルギーやポテンシャル・エネルギーなど、エネルギーの形態によって様々な数式で表されるが、エネルギーそのものは実体がなく、表現も難しい。そこで「エネルギー」を表現するために導入された関数「ラグランジアン」であるが、その変数を入れ替えて、全エネルギーの関数として「ハミルトニアン」が導かれた。ルジャンドル変換は、ラグランジアンからハミルトニアンを導くための変換であった。 20世紀になってシュレーディンガーが波動力学を構築するときに、物質波である軌道電子のエネルギーを記述する演算子としてハミルトニアンを用いた。物理学におけるラグランジアンと化学におけるハミルトニアンはエネルギー以上に重要な関数である。 |
| |
ニュートン力学の再定式化を行った解析力学で用いられたルジャンドル変換は、19世紀に発達した「熱力学」においてもエネルギーの変換に用いられた。
熱力学では、内部エネルギーを「完全な熱力学関数(熱力学ポテンシャル)」として取り扱う時、「内部エネルギー」をルジャンドル変換して独立変数を入れ替えるという手法によって「エンタルピー」などの関数を導いた。特にエンタルピーは、一般的な化学プラント(化学装置)のプロセスにおいて非常に重要な役割を果たしている。化学プラントで重要な変数は、熱、温度、圧力であるが、エンタルピーは、取扱いが難しいエネルギーをエンタルピーで表現し、熱収支などをエンタルピー収支で置き換えて評価するという手法が一般的である。 |
| ②サーモダイナミック・スクエア |
| |
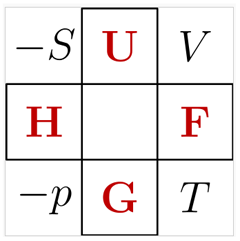
図は、ルジャンドル変換でつながる熱力学関数を表わすニモニックダイアグラム(暗記図)、「サーモダイナミック・スクエア」(Thermodynamic square)である。
ここで、 U:内部エネルギー 、H:エンタルピー F:ヘルムホルツエネルギー、G:ギブスエネルギー 、
変数は S:エントロピー、V:容積、P:圧力、T:熱力学温度である。 |
 |
|
| |
たとえば、内部エネルギーUの体積Vに関するルジャンドル変換から次のようにエンタルピーが得られる。 |
| |
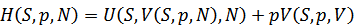
|
| |
「完全な熱力学関数」は熱力学的性質の情報を全て持つ関数であり、4つの熱力学関数はその変数の組み合わせによって完全な熱力学関(熱力学ポテンシャル)となる。エントロピー、熱力学温度、物質量、その他の示量性状態量、示強性状態量などが変数の組み合わせとなり、これらの関係を用いて熱容量、圧縮率などを求めることができる。 |
| ③熱力学におけるエネルギーの表現 |
| |
エネルギーという言葉は、様々な分野に現われるが、定義式をみることがほとんどない。しかも、エネルギーを定義するラグランジアンは実際には観測できない物理量であり、値自体には物理的な意味がないため、これを用いてエネルギーの定式化ができても、非常に抽象的であり、エネルギーそのものを理解することは容易ではない。 |
| |
熱力学では自由エネルギーを表現する関数として、ギブスの自由エネルギー、ヘルムホルツの自由エネルギー、オネスの自由エネルギーというそれぞれ発案者の名前がついた3つの関数が知られている。オネスの自由エネルギーは別名である「熱関数」あるいは「エンタルピー」の方が一般的にはよく知られており、主な化学反応における熱収支は、エンタルピー収支式として記述することができ、ガス屋にとっては最もエネルギーを近くに感じる関数である。
エンタルピーを考える前に熱力学の基本法則を復習しておく |
| |
|
| |
エネルギーという実体のないものを、熱力学の関数に置き換えて表現するという研究が19世紀末から20世紀初頭に行われ、ギブスの自由エネルギーG(1873年)、ヘルムホルツの自由エネルギーF(1882年)、オネスの自由エネルギーH(エンタルピー、1909年)が提唱された。発表はギブス、ヘルムホルツ、オネスの順であるが、ルジャンドル変換の順番からF→H→G と説明されるのが一般的である。
|
| |
| (1)ルジャンドル変換 |
| 熱力学の独立変数には、エントロピー、体積、圧力、温度があり、これらを用いて熱力学の関数を表す時、変数の入れ替えにルジャンドル変換が用いられる。 |
関数 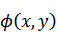 の変数を入れ替えて次の手順で
の変数を入れ替えて次の手順で 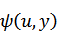 という新しい関数を作る。 という新しい関数を作る。 |
| |
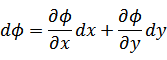 |
|
|
| ここで |
| |
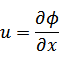 |
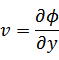 |
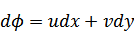 |
| とおく。 |
| 次の新たな関数を導入する→ルジャンドル変換 |
| |
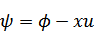 |
|
|
| この関数の微分は次のように簡単になり |
| |
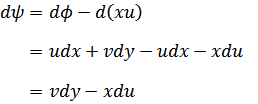 |
元の関数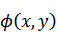 は新たな関数 は新たな関数 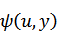 になり、変数は、それぞれ次のように表される になり、変数は、それぞれ次のように表される |
| |
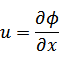 |
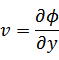 |
|
| |
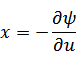 |
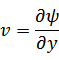 |
|
ルジャンドル変換は、
(新たな関数)=(元の関数)-(変換したい元の変数*変換したい新たな変数)
という簡単な変換である。
ルジャンドル変換は、関数の変数を変えるために用いられる変換で、数学者のアドリアン=マリ・ルジャンドル(1752年~1833年、フランス)によって見出された。解析力学においてラグランジアンからハミルトニアンを導くために考え出されたものであり、これが最もよく知られるルジャンドル変換の応用例であるが、熱力学の関数の変数変換に用いられることでもよく知られている。
しかし、この変換は単に数学的な変換であって、物理学における変数変換が何でもできるというものではない。変換に物理的な意味が必要で、関数と変数の積が同じ物理量の次元を持たなければ変換に意味がない。 |
|
| |
| (2)ヘルムホルツの自由エネルギーFの導出 |
元の関数:内部エネルギー
元の変数:エントロピー
新たな変数:温度
新たな関数=(内部エネルギー)-(エントロピー×温度) |
| |
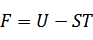 |
|
|
| |
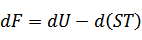 |
|
|
| |
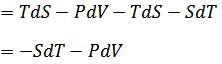 |
| 関数Fの全微分は次のように書けるので |
| |
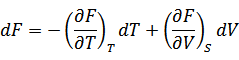 |
| 上式と比べると次の関係が得られる |
| |
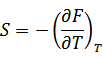 |
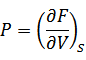 |
|
関数Fを自由エネルギーまたはヘルムホルツの自由エネルギーと呼ぶ。
等温、等積の変化の時、外部に取り出せる最大の仕事はヘルムホルツの自由エネルギーの変化量(減少量dF)に等しい。内部エネルギーの変化量dU全てが取り出せるのではないということが分かる。 |
|
| |
|
| |
エンタルピーの概念は、ヘイケ・カメルリング・オネス(1853~1926年、オランダ)によって導入された。
エンタルピーは、エネルギーを記述するのに用いられるが、エネルギーそのものではなく、ラグランジアンなどと同様、特に物理的な意味を持たない、観測されない量であるということに注意が必要である。 |
| |
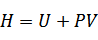 |
| |
右辺第1項Uは内部エネルギーであるが、右辺第2項は、エネルギーと足し算をしているので、この項および左辺のエンタルピーは、エネルギーと次元が等しいことが分かるが、特に物理的な意味を持たない。
定圧条件であれば,右辺第2項を外部への仕事とみなすことができるので、この定義式は、定圧下で系に熱を加えると内部エネルギーと仕事になる、ということを表現している。 |
| |
|
| ④熱力学におけるエネルギーの表現のまとめ |
| |
自由エネルギーとは、全エネルギーから「束縛エネルギー」(温度を維持するために用いられ、仕事を取り出せないエネルギー)を除いた残りであるが、等温条件の下で仕事として取り出し可能な「自由エネルギーF」(エネルギー)と等温等圧条件下で仕事として取り出しが可能なエネルギー(着目する仕事のみに使われる正味のエネルギー)の2種類の定義が可能である。前者は、単に自由エネルギーあるいはヘルムホルツの自由エネルギーと呼ばれ、後者はギプスの自由エネルギーGと呼ばれる。 |
| |
エンタルピーは、内部エネルギーを記述し、計算によって値を求められる熱力学関数であるが、観測できない物理量であり、物理的な意味を持たない。ハミルトニアンが力学エネルギーを記述する関数(あるいは演算子)であるが、観測されず、物理的意味を持たないが、エンタルピーの性質もこれに似ている。
エンタルピーは物理的意味がないため、計算はできるが、値そのものには意味がない。しかし、エンタルピーの変化量は重要な意味を持っており、熱力学におけるエンタルピーの微分は、他の熱力学状態量と同じように扱われ、非常に重要な値となる。たとえば、定圧変化であれば、エンタルピーの変化は、熱エネルギーの変化と同じ意味を持つ物理量となる。
関数としてのエンタルピーには、独立変数の微分との間に重要な関係があり、たとえば、エンタルピーをエントロピーで偏微分すると温度、圧力で偏微分すると体積、物質量で偏微分すると化学ポテンシャルとなり、示強性状態量が導かれる。内部エネルギーや自由エネルギーなど他の熱力学関数も同様に偏微分が示強性状態量を導く。このような熱力学関数の変換を全て暗記するのは容易ではないが、熱力学記憶図やthermodynamic squareなどを参照すると機械的に利用することができる。 |
| |
熱力学の状態を表す主要な4つの関数、内部エネルギー、エンタルピー、自由エネルギー、ギブスの自由エネルギーは、変数のルジャンドル変換によって、互いに変換可能な関係にあるが、この中では、実用的には、エンタルピーが最も使いやすく、深冷空気分離装置をはじめ、様々なプロセスにおいて多用される。
膨張弁からガスを放出する時の「断熱自由膨張過程」は、系外との熱の授受のない「等エンタルピー変化」であり、気体のジュール=トムソン効果は、「等エンタルピー膨張」における現象として定式化された。JT効果が発見されたのは1861年、エンタルピーを表す記号として「H」が科学論文に初めて登場したのは1909年である。 |
| |
熱力学の3つの自由エネルギーのまとめ ※1 |
記号 |
名称、定義 ※3 |
提唱年 |
提唱者 |
別名 |
G |
ギブスの自由エネルギー ※2
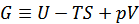
|
1873年 |
ウィラード・ギブス |
ギブスエネルギー |
F |
ヘルムホルツの自由エネルギー
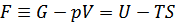
|
1882年 |
ヘルマン・フォン・ヘルムホルツ |
自由エネルギー |
H |
エンタルピー
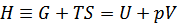
|
1909年 |
ヘイケ・カメルリング・オネス |
熱関数 ※4
オネスの自由エネルギー
|
| ※1 |
参考:東北大学 エネルギー学講座熱制御工学分野琵琶・兵頭研究室「自由エネルギーの幾何学的性質」) |
| ※2 |
ギブスは「物体の熱力学的諸性質の曲面による幾何学的表示」と題する論文で、自由エネルギーを幾何学的に導入した。 |
| ※3 |
自由エネルギーの定義式は、ギブスが示すようにU-V-S空間における平衡曲線から求められており、形式的にはUにTSとpVを足し引きしたものになっている。 |
| ※4 |
エンタルピーという用語はオネスが作った造語である。エンタルピーを熱関数(heat function)と呼ぶことがあり、記号に H を用いるようになった。それまでしばしば、熱を表す記号としてHが用いられていたが、これ以降、熱力学では、記号Hはエンタルピーに、記号Qは熱に用いられるのが普通になった。 |
| |
提唱者のフルネームは以下の通り、 Josiah Willard Gibbs(1839-1903年)、 Hermann Ludwig Ferdinand von Helmholtz(1821~1894年)、 Heike Kamerlingh-Onnes(1853~1926年) |
|
|
| |
|
| ⑤エンタルピーの性質と注意点 |
| |
エンタルピーは、エネルギーを記述するのに用いられるが、エネルギーそのものではなく、ラグランジアンなどと同様、特に物理的な意味を持たない、観測されない量である。 |
| |
| エンタルピーの主な特徴 |
● |
エンタルピーは熱力学の「関数」 |
● |
定義式から分かるようにエネルギーと同じ次元を持つ。 |
● |
エンタルピーは、熱力学の系において、内部エネルギーの代わりに熱エネルギーを表現することができる。 |
● |
定常状態において閉じた系のエンタルピーは保存されるので、一般的な熱収支式をエンタルピー流やエンタルピー流束を用いた収支式として記述できる。 |
● |
エンタルピーには物理的な意味がなく、観測もされない。ただし、勝手に作られた関数ではなく、ルジャンドル変換によって得られる完全な熱力学関数のひとつ |
● |
エンタルピーの絶対値には科学的な意味がない |
● |
エンタルピーの変化量に重要な意味がある |
● |
物性値として、比エンタルピーが利用される(単位モル当たりあるいは単位質量当たりのエネルギーの単位)。基準点は任意であるが、飽和液体をゼロ点にすることが多い。 |
● |
比エンタルピーは、系の圧力変化、組成変化、温度変化などを反映した物性値として与えられるため、エネルギー収支式は非常に簡潔になる |
| 取扱い上の注意点 |
● |
「エンタルピーはエネルギーを表現する関数であるが、物理的な意味がなく、絶対値にも意味がない」ということに十分注意する必要がある。たとえば、異なるデータベースや異なる物質の間で比エンタルピーを比較することはできないので差し引きはできない。エンタルピーの変化量、収支に大きな意味がある。 |
● |
非定常のプロセスでは、エンタルピーは保存されないため、ダイナミックシミュレーションなどでは、基本的には収支式として使用できない。(エンタルピーの保存は、定常あるいは準静的な場合に限られる) |
|
| ⑥エンタルピーの利用 |
| |
熱プロセスの系で、外部との間に仕事の出入りがない場合、一般的には反応の前後でエンタルピーが保存される。たとえば、JT膨張の場合、膨張弁の上流側と下流側では、熱の出入りがなく、「当エンタルピー膨張」によって(実在気体の)温度が変化する。熱交換器では、温流体から冷流体に向かって熱が移動するが、温流体が失ったエンタルピーは冷流体が得たエンタルピーに等しく、次に示すようなエンタルピーを用いた熱収支が成り立つ。 |
| 熱交換器とQ-T線図(エンタルピー利用の例) |
| |
化学プロセスにおいて、熱収支をエンタルピー収支として記述する方法がよく行われている。科学の分野ではエンタルピーは記号Hで示されることが多いが、プロセスの記述では、比エンタルピーが記号hで、エンタルピー流(比エンタルピーに流量を掛けたもの)は、記号Qをで示されることが多く、熱交換器における熱の交換を、温度とエンタルピーの関係で示す「Q-T線図」というものがある。 |
| |
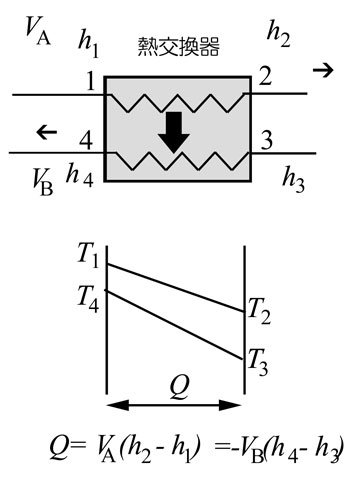 |
図は熱交換器における流体間の熱移動(伝熱)の様子を示すQ-T線図である。
温度の高い流体(温流体)が流量VAで左から右に流れ、温度の低い流体(冷流体)が流量VBで右から左に流れている。それぞれの流体は、温度が T1→T2、 T3→T4
と変化しているが 、それぞれ圧力も変化しており、それぞれ対応する比エンタルピーが、h1→h2、 h3→h4 と変化している。
この時、交換される熱Qは図の下のように表され、このような二流体の熱交換器の場合、横軸をQとして、両端で熱収支(エンタルピー収支)が成り立つ。 |
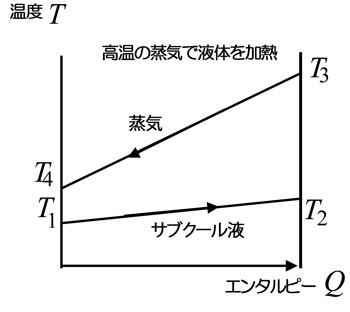 |
図は液体と気体の間の熱交換をQ-T線図で示したもので、比エンタルピーが大きく異なるため、線図は平行から大きく外れる。 |
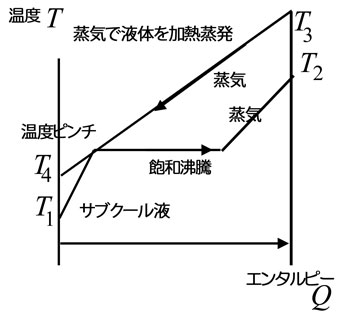 |
図は、熱交換の途中で相変化が起こる場合の熱交換をQ-T線図で示したものである。 両端の温度は前の図とあまり変わらないが、途中の線の形は大きく異なる。
飽和沸騰が続いている間は温度の変化がほとんどない(圧力の変化に相当する分だけ変わる)。図の例では、加熱する側の蒸気と加熱されて蒸発する側の液体の両端での温度が成立している(逆転していない)が、熱交換器内部では温度差が非常に小さい(温度ピンチ)状態が存在している。
横軸は、エンタルピー流であり、実際の熱交換器の長さを表していないため、この例のように温度がピンチするところでは、熱交換に非常に長い距離が必要となり、実質的には不成立ということになる。 |
|