サイト・トップ |
ガスの科学ブログ |
ガスの科学目次 |
| 前の記事 | 28 |
次の記事 |
| 前へ | 目次順 |
次へ |
|
|
|
| ガスの科学トップへ | ||||||||
|
||||||||
| ジュールとウィリアム・トムソン (James Prescott Joule、William Thomson/1st Baron Kelvin/Lord Kelvin) |
||||||||
| 19世紀の中盤、「ジュール=トムソン効果(Joule-Thomson effect)」が、ジェームズ・プレスコット・ジュールとウィリアム・トムソンによって発見、理論化された(1861年)。 | ||||||||
| ファラデーが様々な気体を液化し、気体と液体は同じ物質(分子)の別の形態であることが明らかになった。気体を圧縮あるいは冷却することによって気体を液化することができたのは、実在する気体は理想気体ではなく、条件によっては液体として存在するためである。 気体や熱に関する様々な研究が行われた19世紀には、エネルギーの概念が発明され、「熱力学」という熱と物質とエネルギーに関する最も重要な学問が確立されていったが、そのような時代に、気体を急激に(断熱的に)膨張させると気体の温度が変化するというジュール=トムソン効果が発見され、広い範囲で膨張によって温度が低下することが見出された。 熱は、温度の高い方から低い方へとしか移動しないことが分かっていたので、気体の温度を下げるためにはより温度の低い媒体で冷却しなければならなかったが、この効果が発見されたため、気体はそれ自体でより低い温度の状態になることができるようになり、ガスの冷却技術は急速に進むことになる。(温度の高い方から低い方へと熱が移動するのは、自然の本質であり、その逆を行おうとすると「ポンプ」という仕組みが必要になる) |
||||||||
| ジュール=トムソン効果は、短く「JT効果」あるいは「JT膨張(Joule-Thomson expansion)」と呼ばれることも多く、気体を取り扱う技術者ならば、誰もが知っている物理の現象である。JT効果を用いたJT膨張によって数々の気体の冷却・液化が実現され、アンモニア、硫化水素、二酸化炭素、エチレンなどが液化されるようになった。 | ||||||||
| ジェームズ・プレスコット・ジュール(James Prescott Joulen) | ||||||||
| ジェームズ・プレスコット・ジュール(1818〜1889年、イングランド)は、SIのエネルギーの単位、J に名前を残し、二つのジュールの法則で知られる物理学者である。 | ||||||||
| ジュールの第一法則 | ||||||||
| ジュールの第一法則(Joule's first law)は、電流と発熱量(ジュール熱)の関係を表わす物理の法則である(1840年)。 | ||||||||
| |
||||||||
| ここで、Qは熱量、Iは電流、Rは電気抵抗、t は時間である。 電流が抵抗線を流れるときに発生する「ジュール熱」(Joule heating)は、発熱量が電流によって容易に制御できるため、現在でもジュール熱を利用する電熱器が広く使用されている。このジュールの第一法則は、ハインリヒ・レンツも独立して発見しているため、ジュール=レンツの法則とも呼ばれる(Joule-Lenz law)。 |
||||||||
| ジュールの第二法則 | ||||||||
| ジュールの第二法則は、「理想気体の内部エネルギーはその圧力や体積には依存せず、温度にのみ依存するという法則」という熱力学の法則であり、「エネルギー保存則」の発見につながった。 | ||||||||
| 現在の熱力学で用いられる一般的な記号で表すと、次のように表すことができる。 | ||||||||
| |
||||||||
| |
||||||||
| ここで、U は理想気体の内部エネルギーである。 | ||||||||
| 19世紀初頭、ジュールが生まれる少し前に、トマス・ヤングによって「エネルギー」という新たな概念が提唱された(1807年)。長く続いた「活力論争」という科学の課題に決着をつける新たな概念「エネルギー」が発明され、この新たな概念がその後の科学を大きく発展させることになった。 | ||||||||
| エネルギーには実体がなく、測ることもできないが、様々な形態のエネルギーが考え出され、エネルギーの量は計算することができた。エネルギーそのものを五感で感じとることはできないが、数学的に表現されることが行われ、19世紀から20世紀にかけて、運動エネルギー、ポテンシャルエネルギー、ラグランジアン、ハミルトニアン、エンタルピー、化学エネルギーなど様々な数学的関数によって表現されるようになった。(現代人が、エネルギーと感じているのは、スタミナや持久力、活力、温度の高い状態などや現象、あるいは、効率よくエネルギー変換ができてそれが利用可能な「エネルギー資源」である。「エネルギーのようなもの」を感じているがエネルギーそのものではない) | ||||||||
| 当時の科学はまだ、ラボアジェが提唱した「熱は質量を持たない元素(熱素)であるとするカロリック説」に支配されており、「熱素」という元素とエネルギーの関係を明らかにすることはできていなかった。多くの学者が熱の研究に挑んだ。 | ||||||||
| 「熱の仕事当量」とは、「1calの熱量に相当する仕事の量」と定義され、仕事W と 熱Q の間には次の関係がある。 W=QJ 熱の仕事当量 J を求めることは、熱と仕事が変換可能であることを示すものであり、最初にユリウス・ロベルト・フォン・マイヤーがその算出法を示し(1814年) 、科学者たちは実際にこれを求める研究を始めた。 ジュールは熱の仕事当量を実験により測定(1843年)、 ジュールが行った熱の仕事当量の研究が最も高く評価され、熱力学の第一法則「エネルギー保存則」の発見につながった。 |
||||||||
| 熱はエネルギーのひとつの形態とみなされるようになり、元素ではなくなった。 | ||||||||
| ジュールは引きこもりの科学者である。この仕事当量の研究も最初は怪しまれ、異端者扱いされていたが、やがて、ジュールの実験はマイケル・ファラデーに見出され、ジュールは王立協会の会員となることができた。 そして、その業績を高く評価したウィリアム・トムソンがジュールに声をかけて両者の共同研究が始まった。 |
 |
|||||||
| ウィリアム・トムソン(William Thomson) ケルヴィン卿(1st Baron Kelvin/Lord Kelvin) | ||||||||
|
ジュール=トムソン効果のもうひとりの発見者、ウィリアム・トムソン(1824〜1907年、アイルランド)は、電磁気学、熱力学、地球物理学などにおける数々の業績が知られる物理学者である。 晩年になって、ケルビン卿という英国の爵位が与えられたため、科学史には、トムソンとケルビンの両方の名前が残っている。 ジュール=トムソン効果のトムソンと熱力学温度の単位ケルビンのケルヴィン卿は、同じ人物である。 |
 |
|||||||
| なお、トムソンの名前は、同時代の物理学者として、ジョゼフ・ジョン・トムソン(1856〜1940年、イングランド)も有名である。ここではW.トムソン、J.J.トムソンと記すことにする。ジュール=トムソン効果のトムソンはW.トムソン(ケルビン卿)である。 二人のトムソンは、19世紀後半の古典物理学の権威であるが、20世紀初頭に提唱された原子模型にも二つのトムソン模型があり、少々混乱をすることがある。W.トムソン(ケルヴィン)の方は、20世紀初頭の現代物理学である量子論に否定的な態度をとり、原子の崩壊などの新発見も認めなかった。これに対して、J.J.トムソンの方は、新たな時代の物理学を認め、電子を発見し、ネオンの同位体を発見(放射性ではない安定同位体の初めての発見)、質量分析器を発明するなど、近代物理学の発展にも大きく貢献した。 |
||||||||
| W.トムソンは、ジュールとは、研究者としての経歴が大きく異なる。 わずか10歳で大学に入学、22歳で教授となって英国初の物理学研究室を開いた。ジュール=トムソン効果を発見した後に、大西洋横断ケーブルの敷設に成功して、その功績によって貴族の称号を得てサー・ウィリアムとなり、その後、男爵となって(68歳)からは、ケルヴィン卿を名乗るようになったため、晩年の業績では、ケルヴィン(ケルビン)の名前が残る。 新時代の科学に頑迷に反対はしたが、何といっても、科学的温度の単位は「ケルビン K」であり、W.トムソンは、科学の天才であり、古典物理学の大家である。 |
||||||||
| 若き日のW.トムソンは、同時代の研究者(物理学者)と同じように、電磁気や気体に大きく興味を抱き、研究を行った。デービーやファラデーの影響を強く受け、ファラデーが発見した常磁性、反磁性の研究を行い、透磁率の概念を導入した。 W.トムソンは、電磁気の研究に続いて、気体や熱力学の研究を始めた(1845年、21歳)。その時、ジュールの研究(熱の仕事当量の測定)を高く評価し、これを公表した(1848年)ため、アマチュア科学者であったジュールが科学の世界で注目されるようになった。 |
||||||||
| ジュールとトムソンの共同研究 | ||||||||
| W.トムソンは、気体を自由膨張させると温度がわずかに下がるのではないかということに気付き、このことをジュールに伝えた。ジュールは、人に会うことや、外に出ることを非常に嫌い、自宅の研究室に引きこもって研究を行うことが多かったが、W.トムソンはジュールを誘い、二人は共同で気体の膨張に関する研究を始めることになった(1852年、ジュール34歳、W.トムソン28歳)。 若き天才物理学者W.トムソンは 引きこもりの科学者ジュールを引きずり出し、気体の膨張の研究を始めた。 |
||||||||
| 当時の実験技術では、気体の膨張による温度変化を高精度に検出することは容易ではなかった。しかし、二人は、実験を繰り返し、気体の膨張に伴う気体の温度低下の確認に成功した。 | ||||||||
| 彼らが製作した気体の膨張実験装置は、ジュールの実家の醸造所に設置された。ジュール家が没落した後は、自宅で実験が行われた。実験の中止や数々のトラブルに見舞われたが、実験開始から10年、二人は精密な温度測定に成功し、その成果は、ジュール=トムソン効果として発表された(1861年、ジュール43歳、W.トムソン37歳)。これは、理想気体の理論からは考えられない新発見であった。 科学の新発見は公表されてもすぐには認められないのがほとんどである。論文発表後も彼らの実験は継続されたが、実験場を移転、行く先々で、大きな騒音や煙を出す熱機関(コンプレッサー)は、近隣からの苦情や紛争を引き起こした。実験装置は、3馬力程度。現在の内燃機関であれば、排気量20ccほどの小さなガソリンエンジン相当であるが、17世紀の真空ポンプが巨大科学であったように、最初の熱機関も巨大で物騒な代物であった。 |
||||||||
| ジュール・トムソン効果 | ||||||||
| 後に、ヘイケ・カメルリング・オネス(1853〜 1926年、オランダ)によって熱力学に「エンタルピー」の概念が導入され、ジュール=トムソン効果は「等エンタルピー過程(変化)」と理解されるようになり、次式のように表わされている。 | ||||||||
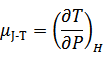 |
||||||||
| ここで、μJ-Tは、JT係数(ジュール=トムソン係数)、単位は、[K/Pa]であり、右辺の下付き添え字Hは、等エンタルピー過程であることを表わしている。 | ||||||||
| 変形するとJT係数は次式で表わされる。 | ||||||||
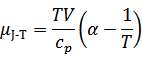 |
||||||||
| ここでαは熱膨張率、Cpは定圧熱容量である。 この式から、JT係数は、物質によって異なることが分かる。理想気体では、熱膨張率は温度に反比例、αT=1であるから、JT係数は常にゼロとなり理想気体にはJT効果がないことも分かる。 JT膨張の現象としてのイメージは、急激に分子間の距離が増大する時に、気体分子が分子間力に対して行う仕事の結果とみることができる。 |
||||||||
| なお、膨張する気体が外部に対して仕事を行う断熱自由膨張(準静的断熱過程における等エントロピー膨張)も断熱過程であるため、用語が紛らわしく注意が必要である。 機械には効率がある(効率は100%にはならない)ため、実際には「等エントロピー膨張」は、実現できないが、膨張タービンや膨張機を用いた外部仕事によって、それに近い膨張過程が実現されており、いずれも、ガスの冷却システムなどに用いられる。 二つの膨張過程は、いずれも断熱膨張であり区別する表現が難しい。そこで断熱自由膨張の方は、「等エンタルピー膨張」「JT膨張」「JT弁」などと表現し、等エントロピー膨張(断熱自由膨張)に近い外部仕事を行う膨張を「タービン膨張」と呼んで区別することが多い。 |
||||||||
| JT係数は、正負いずれの値もとるが、ゼロでない時、JT膨張によって気体の温度が変化する。JT係数が正の時、膨張後にガスの温度が低下、JT係数が負の時、膨張後に温度が上昇するが、多くの条件下で、温度が下がるため、これを利用した気体の液化の研究が進められた。JT膨張によって温度が上昇する場合については、後述する。 | ||||||||
| ジュール=トムソン効果の利用 | ||||||||
| それまで、気体の温度を下げるには、より温度の低い媒体(冷媒)を用意して冷却しなければならなかったが、JT膨張によって、気体がそれ自身で温度を下げることができることが分かったので、技術的に到達可能な低温の範囲が広がった。もし、気体がそれ自身で温度が下げることができなければ、どこまでも低い温度を達成するために、いつまでもそれより温度の低い冷媒を用意しなければならず、最終的には、その冷媒を作る方法がなくなるが、JT膨張のおかげで制約がなくなった。 | ||||||||
| なお、高圧ガスの容器からガスを取り出す時に容器が冷えることがあり、これがJT膨張と勘違いされることがある。JT膨張によって温度が変化するのは、放出されて急激に圧力が低下したガスの方であって、容器に残ったガスの膨張を説明するものではない。ガスを使用すると容器内部に残るガスの量がわずかに減り、圧力もわずかに下がり、容器に残るガスのエンタルピーが減少する。これはガスの量が変化する過程であって、JT膨張による温度変化を意味するものではない。 | ||||||||
| また、LPGを大量に使用すると容器が低温になり着霜し、流量も低下することがあるが、これは、LPGの気化熱の供給が、外気だけでは間に合わない時に見られる現象であって、これも、JT膨張による温度低下ではない。JT膨張は、気体の等エンタルピー変化であり、外部との熱の授受や潜熱によって起こる現象を説明するものではない。 | ||||||||
| なお、ジュール=トムソン効果は、気体の等エンタルピー膨張における温度に関する現象を表わすが、ジュール効果は、導体を流れる電流と発生する熱の関係、すなわちジュールの第一法則(ジュール熱)のことであり、トムソン効果は、温度差がある金属上の2点間に電流を流すと、熱を吸収・発生する現象のことを表わしている。ジュール効果、トムソン効果とジュール=トムソン効果を混同しないようにしたい。 | ||||||||
| 永久ガスと非凝縮性ガス | ||||||||
| ファラデーによって気体と液体は、同じ分子の異なる状態であると理解されるようになり、実在気体の多くが液化されるようになり、ジュールとW.トムソンによるJT効果の発見によってさらに多くの気体が液化できるようになった。しかし、19世紀後半になっても、いくつかの気体は技術的困難さから液化することができなかったため、一時期、これらの物質は、永久ガス(permanent gases)と呼ばれた。 気体の液化が大きく進んだ 1877年の時点では、窒素、酸素、水素、メタンが「永久ガス(永久気体)」であった。当時、周期表でその存在が予言されていたアルゴンやヘリウムなどの希ガスはまだ何も発見されていなかったため、永久ガスの中には含まれていなかった。その後、発見された新元素の中では、ヘリウムが最も液化が困難な永久ガスとなった。 | ||||||||
| 現在では、よく知られているように酸素や窒素は液化され、最も液化温度が低いヘリウムまで、全ての気体が液化されている。冷媒による冷却だけでは、最も液化しにくいヘリウムを液化温度まで下げることができない(そのような温度の冷媒が用意できない)が、オネスは、リンデが製作した冷凍機でヘリウムを段階的に冷却し、最終段階にJT効果を利用してヘリウムの温度を低下させ、世界で初めてヘリウムの液化に成功した(1908年)。 | ||||||||
| この時、永久ガスが消滅した。理想気体は概念上の気体であって実在しないが、特定の条件下では実在気体を理想気体として取り扱うことができない訳ではない。理想気体は実在気体を記述するための基本モデルでもある。これに対して永久ガスというものは、物理モデルではなく、概念そのものが誤っており、用語自体が事典に掲載されていない。19世紀末から20世紀初頭にかけて行われた気体の液化の研究の中で、技術的に液化が困難な物質がいくつかあり、研究者を悩ませたため、一時期(約30年間)、液化できない「永久ガス」が存在するのではないかと思われた時に作られた歴史上の言葉である。永久ガスにリストアップされたガスの液化が実現されたのは、酸素1877年、窒素1883年、水素1898年、ヘリウム1906年である。 工学的には「非凝縮性ガス」という言葉はあるが、ガス屋には、液化しないガスはない。 |
||||||||