サイト・トップ |
ガスの科学ブログ |
ガスの科学目次 |
| 前の記事 | 52 |
次の記事 |
| 前へ | 目次順 |
次へ |
|
|
|
|
|||||||||||
| ③蒸留分離と気液平衡 | |||||||||||
| 酸素は、水の電気分解ではなく空気の蒸留分離で製造されている。地球上にいかに大量の水が存在し、その中に水素原子と酸素原子が含まれていれも、それを分解して酸素を取り出していては莫大なエネルギーを要するので、安価で大量の酸素製造は、空気を原料とする分離法しか現実的ではない。 空気の分離法には吸着法、膜分離法、蒸留分離法があり、その中で最も効率的で大量の酸素を製造できる方法は蒸留法であることを示した。(→(2)空気を分離する方法)。しかし、ここまで分かっていても、この先に、しばしば大きな誤解が生じることがある。蒸留分離とは混合物の気液平衡を利用する非常に簡単な分離法であるが、その仕組みがうまく伝わらずに、誤った説明がしばしばなされる。 |
|||||||||||
| 「沸点差で分ける」、「沸点の違いで分ける」、「液体空気を作ってこれを分離して液体酸素と液体酸素に分ける」、等といった実際の空気分離の仕組みとは全く異なる説明を見かけることがある。 | |||||||||||
| (a)「沸点の違いで分ける」という説明 | |||||||||||
| 実際の空気分離は、気体の空気を原料に、混合物(空気)の気液平衡を利用しているが、これを簡単に説明するのが難しいと感じ、酸素や窒素の沸点の違いで説明しようとする人がいる。 | |||||||||||
| 物質によって沸点が異なるという物性、「沸点の違い」は、昔から知られている。沸点が物質によって異なるということはガブリエル・ファーレンハイトが最初に発見した。 そして、異なる物質が混じって混合物になった液体では、純物質が低沸点のものの方が蒸発しやすいのではないかと考える人も多くいて、実際にそのような傾向が多くみられたため、「沸点の違い」によって分離ができると考えられた。石油の蒸留塔の説明では、しばしば、「沸点の違いによって分離する」という説明をみかける。酸素の方が窒素よりも沸点が高い。 |
|||||||||||
| 沸点が異なっていても分離できない組み合わせも存在するので、現象の説明としては不正確ではあるが、それでも何となく沸点の違いや利用できる例が多い。混合物中の沸点が低い成分「低沸成分」は、沸点が高い成分「高沸成分」よりも気相中に濃縮しやすい傾向があるので、あながち間違っているとは言えない。 | |||||||||||
| 一般的には、「純物質の沸点が低い方が混合物中でも蒸発しやすく」、「純物質の沸点が高い方が混合物中でも液化しやすい」傾向にあるので、それぞれ「混合物中の低沸成分」、「混合物中の高沸成分」と呼ぶので、蒸留とは、混合物を沸点が異なることを利用して分離する操作であるという説明が多くなる。しかし、系とその条件によっては、気液平衡状態において気相と液相の組成が等しくなる「共沸」という現象も知られている。 よく知られる例では、水-エタノール系がある。標準気圧における沸点は、水が100℃、エタノールが78.3℃であるから、エタノールの方が「蒸発しやすい」と思われるが、ある濃度になると液相中と気相中のエタノールの濃度は等しくなる。蒸発しやすいはずのエタノールと蒸発しにくいはずの水が同じ挙動を示すため、それ以上の濃縮ができなくなり、96wt%以上のアルコールを含む蒸留酒は製造できない。水-塩化水素系にもこのような混合物があり、これらは共沸混合物と言われ、各成分の沸点が異なっていても、蒸留では分離できない。 |
|||||||||||
| (b)「蒸気圧の違いで分ける」という説明 | |||||||||||
| 「蒸気圧の違い」を利用するという説明は、もう少し正解に近い。理想溶液に関する「ラウールの法則」があり、これは「混合溶液の各成分の蒸気圧は、それぞれの純液体の蒸気圧と混合溶液中のモル分率の積で表される」というものである。実在する物質の説明としては正しくないが、窒素の蒸気圧は同じ温度の酸素の蒸気圧よりも高いので、混合液体の蒸気は、蒸気圧比で分配されるということになり、気相中の窒素濃度が高くなり、これを利用して蒸留分離ができるといった説明もなんとなくできる。これは、もしラウールの法則が成り立てば、ということであるが、液体空気は、理想溶液ではなく、低温空気も理想気体ではないので、分圧という概念も成り立たない(ラウールの法則は成り立たない)。 | |||||||||||
| (c)「窒素が速く蒸発する」という説明 | |||||||||||
| 液体窒素が「速く蒸発」し、液体酸素は「蒸発が遅い」とするという説明も気液平衡の説明としては間違っている。蒸発が速いか遅いかは、周囲の環境との間の熱の移動に伴う輸送現象の結果である。 それぞれの物質の物性が異なり、伝熱、物質移動の結果、蒸発する速度に違いが生じている。混合物である液体空気を放置すると、窒素が速く蒸発し、残った液体中には酸素が濃くなっていくが、蒸発の速度が気液平衡を説明しているのではなく、気液平衡と物質移動の結果、濃縮が進むのであって、原因と結果が逆である。 これで蒸留分離や気液平衡を説明することはできない。 |
|||||||||||
| (d)空気を液化するとできるのは「液体空気」 | |||||||||||
| 空気が蒸留によって分離できるのは、気体と液体が共存し平衡にある時、気液の組成が異なるという性質(物性)「気液平衡」が利用できるからである。 ある物質が気体あるいは液体の状態にある時、分子の状態は、分子間力を用いて説明されなければならない。したがって、窒素ガスであれば、窒素-窒素の間の分子間力、酸素ガスであれば、酸素-酸素の分子間力で説明され、液体窒素中の窒素、液体酸素中の酸素も同じように分子間力で説明される。 空気は、酸素-窒素-アルゴンの混合物であり、それぞれがある濃度で含まれているもの全てを「空気」と呼んでいる。大気の最下層にある空気(対流圏)は、酸素が21%、アルゴンが9300ppm、残りが窒素と大まかに組成が決まっているが、空気の蒸留装置の中の空気は、酸素の濃度がゼロに近いところから純粋な酸素に近いところまで様々である。空気の中の酸素分子の周りには、同じ酸素分子があることも、窒素分子やアルゴンがあることもある。気体が液体になるということは、分子間力が大きくなって、分子が動きにくくなる状態であるから、空気が液化するときの分子間に働く力は、窒素分子、酸素分子、アルゴンが交じり合った状態での相互作用である。 したがって、窒素だけ、酸素だけの気体の分子間力と空気の分子の分子間力は全く異なっているということが理解できる。たとえば、液体窒素中の窒素分子と液体空気中の窒素分子では、その周囲にある分子が異なり、挙動が全く異なるので、液体空気は液体窒素の物性を受け継いではいない。1atmの窒素ガスは、77Kにならないと液化しないが、空気は、これよりもはるかに高い温度で液化し、その液体空気の中には、窒素分子も含まれている。要するに、空気を液化してできるのは(平衡組成を持つ)液体空気であって液体酸素ではない。 非常に困ったことに、高校の理科や大学の実験テキストなど、それなりにまともな教育現場でも、「空気を冷やすと酸素だけが液化する」という説明を見かけることがある。 |
|||||||||||
| (e)「沸点差で分ける」という説明 | |||||||||||
| 「沸点」という専門用語を使っているため「沸点差で分ける」という説明は、もっともらしく聞こえてしまい、「沸点差」という専門用語があるかのようであるが「化学工学用語事典(1967年版)」にはそのような項目はない。沸点の違い、蒸気圧の違いなど、なんとなくぼんやりとした説明でも怪しいが、「差」という数字を持ってこられると、これは明らかに説明がおかしいと言うしかない。
圧力1atmの時の酸素の沸点が90K、窒素の沸点が77Kである。この2つの数値は比較的よく知られている。しかし、この二つの物性値の「沸点差」13Kには科学的な意味がない。これを利用することもできなければ、これで分離の仕組みを説明することもできない。酸素や窒素だけでなく、異なる物質の「沸点」を引き算することはできない。 酸素と窒素の「沸点差」で分けるというのでは、気体混合物の液化の仕組みや空気分離のプロセスを誤解させる。そもそも事典にものっていない用語を作るというのは、少なくともプロのガス屋がやってはいけないひどい説明である。 |
|||||||||||
| (f)空気の気液平衡 | |||||||||||
| 気液平衡は、熱力学における平衡のひとつであり、気体と液体が共存して平衡状態にある時に、気相と液相では組成が異なるという現象が多いということがよく知られている。これを利用して目的成分を分離濃縮するのが蒸留(蒸留操作、蒸留分離)である。 「気液平衡」は、熱力学で取り扱われるが、化学工学(蒸留工学)のテキストでもよく取り上げられるので、用語としては比較的よく知られている。しかし、実務的には、蒸留装置の設計者や物性の研究者でなければ、気液平衡の詳細まで知る必要がないため、工業一般では、あまり議論されることはない。気液平衡を専門にする研究者からみれば奥の深い分野であるが、ここでは、空気の場合の考え方だけを示すことにする。 |
|||||||||||
| 図に、気液平衡の概念を示す。容器の中に液体空気と気体空気があり、平衡状態にあるとする。 実際の容器では、容器の上と下では圧力が異なり、温度も一様になることはほとんどないので、気液が接触しているところ(気液界面)だけを気液平衡と考えるのが正しいが、ここでは、容器全体が同じ温度、圧力、平衡であるとする。なお、実際の低温液化ガスの貯槽では、容器の上部と底部は圧力が異なり、この圧力差を用いて液面の高さを測定している(液面計の実体は差圧計である)。 厳密な相平衡を定義するには、化学ポテンシャルあるいはフガシティ(実在気体を取り扱いやすくするために導入する仮想の圧力)で表現しなければならないが、ここでは、「系全体の温度、圧力が等しく、気液の量、それぞれの組成が変化しない、熱力学的な平衡状態」にあるとする。分子は運動しており、液体は蒸発し、気体は液化しているが、それぞれが等しく釣り合っているので、見かけ上は何の変化もない「平衡」状態にある。 |
|||||||||||
|
|||||||||||
|
|||||||||||
| 空気の気液平衡では、特定の成分が選択的に蒸発したり凝縮したりして濃度が100%になることがないので、それぞれ目的の濃度の製品を得るために、気液平衡を何度も利用する。このような装置を蒸留塔(蒸留装置)と呼ぶ。 空気の場合、気相と液相の組成が全く同じになることはない、すなわち、酸素と窒素とアルゴンは共沸混合物を作らないので、蒸留分離が途中で止まることはなく、蒸留塔の片側で酸素が、反対側で窒素が高濃度に濃縮される。(計算上は、無限に長い蒸留塔があれば100%に濃縮されるが、実際にはあり得ない) アルゴンは気相中に濃縮される場合と液相中に濃縮される場合がある。したがって、蒸留塔の中間部ではアルゴンは、気相中にも液相中にも濃縮されない点があり、濃度のピークが生じる。100%に近い高濃度のアルゴンを得ることはできないため、中間にアルゴン濃縮専用の蒸留塔(サイドカラム)を置き、高濃度のアルゴンを製造する(具体的なプロセスは別項)。 |
|||||||||||
| (g)「沸点差や沸点の違いで分けることができる」空気分離 | |||||||||||
| 気液平衡を考えないで、「沸点差や沸点の違いで分けることができる」と考えると、蒸留塔を用いない空気の冷却だけによる空気分離法にたどりつくという例を示す。 | |||||||||||
|
|||||||||||
| この時、気相中には窒素とアルゴンがあるが、それぞれの沸点は83Kと77Kなので「液化はしない」。その気体をさらに冷却すると今度は83Kでアルゴンが液化して分離される。これによって酸素とアルゴンが分離され、残りが窒素となる。 発明者は、世界ではじめて空気を分離したという発明を主張したのではなく、従来技術である空気の蒸留分離装置と比較、従来技術である空気分離装置は巨大で複雑で効率がよくないものであり、この発明はそれを超えるものであると主張している。空気の分離は世界初ではないため、同じ目的の従来技術に比較して優れている点を示しているので、従来技術が蒸留分離であるということを知った上での発明である。精密な温度制御によって蒸留塔を必要とせずに容易に空気が分離できる、という主旨の特許である。従来技術である蒸留塔を否定し、気液平衡という概念を無視した特許であるが、これは科学的な事実に反しており実現不可能であり、誰も異議を申し立てなかったようである。その後、実用化されたという話しも聞かない。 誰しも勘違いや間違いはあるが、この発明は、空気分離を基盤技術とする産業だけでなく蒸留分離そのものを否定しているようにみえる。 |
|||||||||||
| (h)極端に物性が異なる物質の混合物の場合 | |||||||||||
| 一方、物性が大きく異なり、沸点や凝固点が極端に異なる系では、前の図に近いことが起こる。 たとえば、空気を冷却していけば、空気中の水蒸気は、ほぼ選択的に結露し、さらに温度を下げると凝固して氷になり(約273K)、分離・除去することができる。さらに、空気の温度を下げると、二酸化炭素が昇華(固化)する(約195K)。この時、空気に含まれる水蒸気や二酸化炭素以外の成分、すなわち酸素や窒素やアルゴンは、水や二酸化炭素とは物性が大きく異なるため、厳密にこれらの成分との間の気液平衡を考慮しないのが普通である。水分子や二酸化炭素分子どうしの分子間力と酸素や窒素の分子間力が極端に異なるため、空気中の水蒸気の液化や二酸化炭素の昇華は、ほぼ選択的に起こる現象と考えることができる。 |
|||||||||||
| 深冷空気分離装置では、原料空気中の水分と二酸化炭素を蒸留装置の前で予め除去するための装置が必要である。空気を蒸留分離する温度では、水や二酸化炭素は固体になるため、そのままの空気(生空気)では装置を閉塞させる。そこで、深冷空気分離装置は、発明された当初から、これらの成分を除去するための装置(前処理装置と呼ぶ)を備えている。 最初はカセイソーダなどを用いた吸収法があったが、次に蓄冷器方式あるいは可逆式熱交換器方式の前処理が実用化された。水や二酸化炭素が空気の主成分とは極端に物性が異なることを利用して、冷却・除去する方法である。 原料空気を熱交換器で冷却する過程で熱交換器の伝熱面に水や二酸化炭素が選択的に凝固し、氷やドライアイスができるので、この現象を利用して予備精製を行うものである。 なお、昔はこの方法でも性能としては十分であったが、氷やドライアイスの蒸気圧が残るため、原料空気から完全には水分と二酸化炭素を除去できないこと、また、熱交換器の再生に用いる再生ガスのロスが大きく、製品量の制約があることなどから、空気分離装置により高性能(低減単位、高収率、高純度)が要求されるようになってからは、この方式は廃れ、合成ゼオライトなどによる効率のよい吸着方式の前処理に置き換えられている。 |
|||||||||||
| (i)もう少し空気の気液平衡を考える | |||||||||||
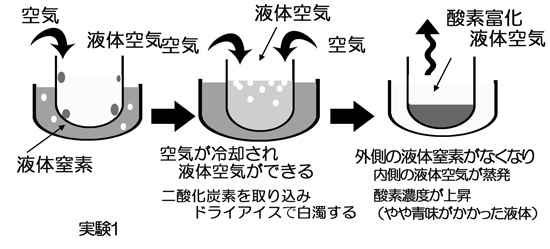
| 図のような液体窒素を使った理科の実験を考える。液体窒素は比較的入手しやすいこともあって、理科の実験によく現れる。 | |||||||||||
 |
|||||||||||
| 実験1:液体窒素を容器にいれ、その中にもうひとつの空の容器を置く。液体窒素の容器は開放されているので、窒素は、ぼこぼこと沸騰し、大気圧であれば、温度は、およそ77Kになっている。 周囲は普通の空気なので、中の容器の内側には水滴のようなものがつき、徐々に液体が溜まっていく。これが「液体空気」である。液体酸素はよく知られているように薄い青色であるが、液体空気もわずかに青く見えるかも知れない(濃度による)。この時、空気中の二酸化炭素が取り込まれ、固化しドライアイスになるので、液体窒素も液体空気も白く濁ることが多い。空気の温度が下がってできる液体は、液体空気であるが、空気中よりもやや酸素濃度が高い(様々な条件で決まるが、およそ35~40%)。 外側の容器の液体窒素が蒸発して減ってくると中の液体空気も外気によって加熱され蒸発していく。この時、気液平衡によって気液界面での気相中の窒素濃度が高くなるため、窒素の方が多く蒸発し、早く減り、残った液体空気の酸素濃度が徐々に高くなっていく。 この実験によって体験できるのは、空気も低温になれば液体になるということ、できた液体空気に少し色がついたように見えたら、それは、おそらく液体酸素は青いであろうと想像できること、二酸化炭素は固化してドライアイスになること、などである。 時に、「空気が冷やされて液体酸素ができる」などという嘘の解説をみかけることがあるが、そんなことが起こるのならば、誰も蒸留塔などというものを作る訳がない。空気が冷やされてできる液体は液体空気である。 |
|||||||||||
|
|||||||||||
| この実験は、実験1のような比較的閉じた系での気液平衡ではなく、周囲の空気との間の物質移動や伝熱を伴う現象であるから、連続的に空気が供給され液体窒素がなくなるまで、液体空気が作られ続ける。できた液体空気の組成を予測するのは簡単ではないが、可燃物が非常に燃えやすくなっていようなので、おそらく酸素濃度は30%以上にはなっていると想像する。 空気中の酸素が選択的に液化するということはないので、この方法では酸素富化液体空気はできるが、液体酸素は作れない。前述のような特許出願ともなるとさすがに珍しいが、空気が冷えると酸素が選択的に液化すると思っている人は、時々いる。 「液体窒素を満たした冷却トラップを大気に開放したまま放置すると、液体酸素がたまる」といった説明をみかけることもある。この説明は不正確で、気液平衡や蒸留の考え方に対して大きな誤解を生じさせる。この液体を酸素と考えるのは、混合気体の液化や気液平衡を全く理解していないということになる。 |
|||||||||||
|
|||||||||||
| (j)液体窒素を用いた実験の危険性 | |||||||||||
| 上記の理科の実験は、気体の液化や気液平衡に関する誤解を説明するために示した。 液体窒素は比較的入手しやすい「低温液化ガス」であるが、他の化学物質同様、その性質を知らずに不用意に取り扱うと危険な物質である。この実験のように、液体窒素を取り扱っているときに、思いがけず液体空気ができてしまうことがあり、十分な注意が必要である。 |
|||||||||||
| 安全上守るべき基本的な注意点のひとつめは、凍傷である。 液体窒素は、比熱が小さいため、短時間であれば触れてもあまり危険ではないと思っている人もいるようであるが、素手で絶対に触れてはならないものである。 液体窒素や液体空気のような低温の液化ガスは、粘度や表面張力が小さく、繊維に浸み込みやすいため布製の手袋も危険である。作業には革製の手袋が必要である。 目や皮膚を凍傷から守るための防具は必要であり、産業ガスの現場では、デュワー瓶に液体窒素を充填する時には、シールド付のヘルメットと革手袋の使用を義務付けていることが多い。 |
|||||||||||
| 2つめは、酸欠である。 液体窒素は周囲が室温であれば、常に沸騰・蒸発している。蒸発直後の窒素は、まだ温度が低く、周囲の空気よりも重く、空気とよく混ざっていないので、局所的に酸素欠乏空気が発生しやすい。 蒸発しているところを覗き込んだり顔を近づけたりしてはならないのは当然であるが、狭い実験室で使用する時は換気に注意し、酸欠事故防止のための酸欠モニターが必要である。 特にエレベータのような狭い密室に液体窒素を持ち込むことは非常に危険である。容器の転倒や停電による不測の閉じ込めなどのリスクを考えると、液体窒素の容器持ってエレベータに乗るのではなく、面倒でも、容器を載せる階とそれを受け取って降ろす階の外に人が立ち会い、人は同乗しないようにすべきである。 |
|||||||||||
| 3つめは、液体空気の持つ高い支燃性に注意することである。高濃度酸素が持つ高い支燃性とその危険性はよく知られているが、液体空気は酸素富化空気になりやすく、放置しておけば少しずつ酸素濃度が高くなるので、支燃性に関しては、高濃度酸素と同等に注意を払う扱うべきである。上記の液体窒素の実験にみられるように、周囲の空気が液化して容易に液体空気が発生してしまうため、思いがけないところでの高濃度酸素の事故が起こりうる。 | |||||||||||
| 液体酸素は液体窒素ほど手軽に実験室に持ち込まれることはないが、液体酸素を取り扱う時に最も重要なことは、可燃物に近づけないということである。特に油脂、残留油分は注意が必要で、酸素(液体酸素だけでなく気体の酸素も同じ)を取り扱う時の器具は十分な脱脂が必要であり、ゴム、ビニール、プラスチックなどの可燃物との接触は避けなければならない。 酸素=禁油、はガス屋の常識であるが、液体空気も危険性としては、酸素や液体酸素とほぼ同じものだと考えておいた方がよい。 |
|||||||||||
| カール・フォン・リンデは、火薬の材料不足を補うために液体酸素爆薬(LOX、Liquid Oxygen eXplosive)を発明し、これは50年ほど前までは鉱山で使用されていた。取扱いが難しいため現在は使われていないが、液体酸素は、使い方によっては爆薬の代わりもなるものである。簡単に取扱うことができる安全な物質ではない。専門知識と十分な準備、安全に配慮した取扱いが必要である。 現在では、液体酸素を供給源とする医療用酸素供給装置が開発され手軽に利用できるようになっているが、これはガソリンで動く自動車が普及しているのと同じようなもので、物質として完全に安全なものでなくても、安全な装置、仕組みと正しい知識、取り扱いがあれば、日常生活の中でも安全に使えるということである。しかし、ガソリンをコップに入れて机の上に放置する人はいないように、液体酸素もビーカーに入れて放置できるほど手軽なものではないということは忘れないようにしたい。 入手が容易で実験にもよく用いられる液体窒素であるが、液体窒素のまわりには液体空気ができる可能性が高く、中途半端な知識で取り扱うのはとても危険である。 |
|||||||||||
| (k)その他の誤解 | |||||||||||
| 「沸点差で分ける」、「沸点の違いで分ける」、などの誤解と同様に「液体空気を作ってこれを分離して液体酸素と液体酸素に分ける」といった誤解をみかけることがある。 これは実際の空気分離の仕組みとは全く異なる説明である。 |
|||||||||||
| たとえば、比較的、正確と思われているウィキペディア日本語版でも、アルゴンの製造法の説明で、「液体空気を分留して液体酸素と液体窒素に分ける時にアルゴンが製造される」(2015年8月現在)とある。 蒸留は気液平衡を利用するので、気体と液体が共存する状態が必要である。したがってわざわざ「液体空気」を分留するという表現は違和感がある。酒や石油を蒸留する時に「液体の原酒」を蒸留するとか「液体の原油」を分留するとは言わない。 実際の空気分離プロセスを短く表現するのであれば、「空気を酸素と窒素に分離しその時にアルゴンを製造する」という方が実際に近い。「液体空気を液体酸素と液体窒素に分離する」という表現は不正確とまでは言わないが、わざわざ「液体」と書くと、全体のプロセスをかなり誤解させる。 |
|||||||||||
| 確かに、120年以上前に最初に空気の蒸留分離が行われた時は、わずかな量の液体空気が製造され、それを原料として酸素が製造されたが、それは実験室規模でごく少量の酸素が製造された時の話である。ラムゼーが空気の中に窒素と酸素以外にアルゴンがあることを発見、その他に何か入っているののではないかと科学的に調べ、ネオン、クリプトンなどの新元素を発見した時は、確かに液体空気を原料にして試料を採取したようである。(→希ガスの科学(1) アルゴンの発見) しかし、酸素や窒素が工業的に生産されるようになってからは、原料は液体空気ではなく、気体の空気である。製品として必要なのは液体酸素ではなく気体の酸素である。 気体の空気を原料として気体の酸素と窒素を製品として取り出すのが、一般的な空気の蒸留分離である。 プロセスに追加のエネルギーを投入すれば、液体酸素や液体窒素を製品として取り出すことができるので、一部の製品を液体で採取したり液体製品専用の装置を設計・製作することも可能であるが、通常は主に気体の製品を取り出すのが空気分離装置である。 |
|||||||||||
|
|||||||||||
|
|||||||||||